Minerali, njihov nastanak, sastav, svojstva i značenje. Pojam minerala. Kemijski sastav i fizikalna svojstva minerala. Geologija i njezine grane: mineralogija, petrografija, povijesna geologija, tektonika, inženjerska geologija, hidrogeologija
Osnova za klasifikaciju minerala je kemijski sastav minerala. Na temelju ove značajke razlikuju se sljedeće klase minerala: :
Silikati
Hidroksidi (hidroksidi)
karbonati
Sulfati
Sulfidi
Fosfati
Halidi
Izvorni elementi
Organski spojevi
Mineralne klase i kemijski sastav minerala:
Osnovna karbonatna struktura je jedan atom ugljika vezan na tri atoma kisika. Karbonati uključuju druge elemente kao što su kalcij, željezo i bakar. Kalcit je najčešći karbonatni mineral. Azurit i malahit, prikazani na donjoj slici, su karbonati koji sadrže bakar umjesto kalcija.
Halogeni minerali su soli koje nastaju isparavanjem slane vode. Halit je halogenidni mineral, ali kuhinjska sol nije jedini halid. Kemijski elementi poznati kao halogeni vežu se s različitim metalnim atomima i tvore halidne minerale.
Može se izraziti kemijskim formulama – empirijskim i strukturnim. Empirijske formule pokazuju kvantitativni omjer elemenata koji čine mineral. Na primjer, empirijska formula ortoklaza može biti K2 Al2 Si6O16. Ova je formula vrlo prikladna za opisivanje sastava, ali ne odražava prirodu međudjelovanja veza elemenata u strukturi minerala. Ista se formula može dati u obliku molekularnih spojeva različitih oksida, što je zgodno za izražavanje reakcija u kojima sudjeluju minerali. Ova formula će se zvati strukturna i može se napisati u ovom obliku: K2 OAl2 O 3 6SiO2
Oksidi sadrže jedan ili dva metalna elementa u kombinaciji s kisikom. Mnogi važni metali pojavljuju se kao oksidi. Hematit s dva atoma željeza do tri atoma kisika i magnetit s tri atoma željeza do četiri atoma kisika oba su željezni oksidi.
Fosfatni minerali su po atomskoj strukturi slični silikatnim mineralima. U fosfatima, fosfor, arsen ili vanadij vežu se s kisikom u tetraedre. Postoji mnogo različitih minerala u fosfatnoj skupini, ali većina je rijetka. Sulfatni minerali sadrže atome sumpora vezane na atome kisika. Poput halogenida, nastaju tamo gdje slana voda isparava. Skupina sulfata sadrži mnogo različitih minerala, ali samo je nekoliko uobičajenih.
Dvije su glavne skupine:
1) Konstantan kemijski sastav (na primjer SiO2, FeS2). Ova grupa
minerale je prilično lako proučavati;
2) Minerale koji tvore izravne spojeve prilično je teško proučavati. Ovi spojevi uključuju minerale koji imaju različite nečistoće (plinovi, otopine, suspendirane čestice iu obliku pojedinačnih elemenata uključeni u kristalnu rešetku tvari bez narušavanja njenog oblika).
Gips je uobičajeni sulfat s različitim manifestacijama. Pronađeni su ogromni kristali gipsa od 11 metara. To je otprilike isto kao školski autobus! Iako narančasti kristali s lijeve strane ne izgledaju kao bijeli pijesak s desne strane, i kristali i pijesak su gips.
Sulfidi nastaju kada se metalni elementi spoje sa sumporom. Za razliku od sulfata, sulfidi ne sadrže kisik. Pirit, ili željezni sulfid, uobičajeni je sulfidni mineral poznat kao budalasto zlato. Ljudi mogu zamijeniti pirit za zlato jer su dva minerala sjajna, metalna i žuta.
Mnogi minerali koji imaju isto kemijski sastav minerala, mogu imati različite strukture i izgled kristali, tekstura, a samim time i različiti fizička svojstva. Ovo svojstvo minerala naziva se polimorfizam. Primjer polimorfizma je ugljik. Ovisno o uvjetima kristalizacije, može formirati dvije poliformne varijante - dijamant i grafit, koji imaju različit raspored ugljikovih atoma u prostoru.
Da bi tvar bila mineral, mora biti prirodna, anorganska, kristalna čvrsta, koji ima karakterističan kemijski sastav i kristalnu strukturu. Atomi u mineralima raspoređeni su u pravilne, ponavljajuće uzorke koji se mogu koristiti za identifikaciju tog minerala. Kemijska značajka svake skupine: prirodni elementi - samo jedan element; silikati - silika tetraedar; fosfat - fosfatni tetraedar; karbonati - jedan atom ugljika s tri atoma kisika; halogenidi - halogen vezan na atom metala; oksidi - metal spojen s kisikom; sulfati - sumpor i kisik; sulfidi - metal sa sumporom, bez kisika. Opsidijan je staklo koje nastaje kada se lava toliko brzo ohladi da se atomi ne mogu rasporediti u kristale. Što je sa svim mineralima u skupini silikata? Koja je njihova razlika? Jedan uzorak ima kemijski sastav s omjerom dva atoma željeza prema tri atoma kisika. Drugi uzorak ima kemijski sastav s omjerom tri atoma željeza prema četiri atoma kisika. Sadrže iste elemente: jesu li isti minerali? Po čemu se mineralna skupina prirodnih elemenata razlikuje od svih ostalih mineralnih skupina? Na izletu u Prirodoslovni muzej pronaći ćete dva minerala slične boje. Iz njihovih kemijskih formula jasno je da jedan mineral sadrži elemente cinka, ugljika i kisika. Drugi mineral sadrži elemente cink, silicij, kisik i vodik. Vaš prijatelj vam kaže da su minerali u istoj skupini minerala. Zašto opsidijan, prirodno staklo koje nastaje hlađenjem lave, a ne mineral? Umjetnici su mljeli mineral azurit kako bi napravili šarene pigmente za boje. Je li azurit u prahu još uvijek kristalan?
- Minerali se prema kemijskom sastavu dijele u skupine.
- Što je kristal?
- Koje elemente sadrže svi silikatni minerali?
- Objasnite svoje razmišljanje.
- Kojih je osam glavnih mineralnih skupina?
- Zašto se dijamanti izrađuju u laboratoriju, a ne od minerala?
- Je li ugljen, nastao prvenstveno iz raspadnutih biljaka, mineral?
- Je li ovo stijena?
Ulazak vode kemijski sastav minerala, dijeli se prema jačini veze: konstitucionalni (najčvršće povezan s kristalnom rešetkom, kristalizacijski (također povezan s kristalnom rešetkom, ali slabije i stoga se može ukloniti na visokim temperaturama); ziolit (voda, kao da je otopljena u kristalu).Dodavanje konstitucionalne vode znači stvaranje posebnog oblika minerala, a njegovo uklanjanje uništava mineral.
Kristalna tvar i njezina struktura
Glavna je komponenta raznih vulkanskih stijena kao što su nefelin sijenit, nefelin monzonit i nefelin. Glavna razlika između njih su različiti omjeri širine i visine slike i dostupni razmaci polja. U stijenama nefelinskog monconita K-polje i polja plagioklasa prisutni su u približno jednakom omjeru.
Nefelin sadrži samo male dijelove feldspata, a kamen se sastoji pretežno od nefelina. Postoji vrlo malo prirodnog nefelina s ovom "čistom" kemijom, iako tvori stabilnu strukturu i namijenjen je za upotrebu u izradi keramike i stakla. Ovaj rezultat odražava činjenicu da alkalni položaj natrija i kalija ima zanimljivu razliku u zahtjevima prostora unutar nefelina. Struktura ima.
Dodatak kristalizacijske vode i njezino uklanjanje na visokim temperaturama značajno utječe na mnoga fizikalna i kemijska svojstva minerala. Na primjer, dodavanjem kristalizacijske vode anhidrit prelazi u gips. Istodobno se njegov volumen povećava na 60%. Minerali mogu relativno lako gubiti i obnavljati ziolitu vodu, mijenjajući neka svoja svojstva (indeks loma, struktura).
Postoji četvrti dio, koji je nešto veći od ostala tri. S ove veće strane, veći ioni kalija bolje odgovaraju. Minerali čiji je kemijski sastav blisko povezan s alkalijskim feldspatima, ali siromašni silikatima, nazivaju se feldspati. Kao rezultat toga, nalaze se u stijenama siromašnim silikatima koje sadrže druge nesilikatne minerale i kvarc. Da je kvarc bio prisutan tijekom procesa kristalizacije, reagirao bi sa svakim feldspatom i formirao feldspat.
Postoji samo nekoliko nalazišta glinenca. Nefelin reagira s kiselinama, ali ne stvara mjehuriće kao mnogi karbonati. Ako se zdrobi, otapa se u klorovodičnoj kiselini i uzorci čistih minerala urone se u kiselinu, zbog čega izgledaju zamućeni ili smrznuti. Ovo može biti korisno u razlikovanju nefelina od sličnih mrlja na terenu, skapolita i kriolita.
Klase minerala - članak na web stranici “student builder.ru”
Minerali su čvrste prirodne tvorevine koje čine stijene Zemlja, Mjesec i neki drugi planeti, kao i meteoriti i asteroidi. Minerali su u pravilu prilično homogene kristalne tvari s uređenom unutarnjom strukturom i određenim sastavom, koji se može izraziti odgovarajućom kemijskom formulom. Minerali nisu mješavina sitnih čestica minerala, poput šmirgla (sastoji se uglavnom od korunda i magnetita) ili limonita (agregat getita i drugih željeznih hidroksida), oni također uključuju spojeve elemenata s neuređenom strukturom, poput vulkanskog stakla (opsidijan , itd.) .). Mineralima se smatraju kemijski elementi ili njihovi spojevi nastali kao rezultat prirodnih procesa. Najvažnije vrste mineralnih sirovina organskog podrijetla, kao što su ugljen i nafta, isključene su iz popisa minerala. Mineralogija je znanost o mineralima, njihovoj klasifikaciji, kemijskom sastavu, značajkama i obrascima građe (građe), podrijetlu, uvjetima u prirodi i praktična primjena. Za dublje objašnjenje unutarnja struktura minerala i njihove veze s poviješću Zemlje, mineralogija uključuje matematiku, fiziku i kemiju. Koristi kvantitativne podatke u većoj mjeri nego druge geološke znanosti, budući da su fina kemijska analiza i precizna fizikalna mjerenja nužna za primjereno opisivanje minerala.
POVIJEST MINERALOGIJE
Korištene su kremene ljuskice s oštrim rubovima primitivni čovjek kao oruđe za rad već u paleolitiku. Kremen (fino zrnata vrsta kvarca) dugo je bio glavni mineral. U davna vremena čovjeku su bili poznati i drugi minerali. Neki od njih, poput trešnjevog hematita, žuto-smeđeg getita i crnih oksida mangana, korišteni su kao boje za oslikavanje stijena i tijela, dok su se drugi, poput jantara, žada i samorodnog zlata, koristili za izradu ritualnih predmeta , nakit i amajlije. U Egiptu preddinastičkog razdoblja (5000-3000 pr. Kr.) mnogi su minerali već bili poznati. Za ukrašavanje su korišteni samorodni bakar, zlato i srebro. Nešto kasnije počinje se izrađivati oruđe i oružje od bakra i njegove legure bronce. Mnogi minerali korišteni su kao boje, drugi za nakit i pečate (tirkiz, žad, kristal, kalcedon, malahit, granat, lapis lazuli i hematit). Trenutno minerali služe kao izvor za proizvodnju metala, građevinskih materijala (cementa, gipsa, stakla itd.), sirovina za kemijsku industriju itd. U prvoj poznatoj raspravi o mineralogiji, O kamenju, Aristotelova učenika, Grk Teofrast (oko 372.-287. pr. Kr.) minerale je dijelio na metale, zemlju i kamenje. Otprilike 400 godina kasnije, Plinije Stariji (23.-79. n. e.), u zadnjih pet knjiga Prirodoslovlja, sažeo je sve informacije o mineralogiji dostupne u to vrijeme. U rani srednji vijek u zemljama arapskog istoka koje su prihvatile znanje antička Grčka I drevna Indija, znanost je cvjetala. Srednjoazijski enciklopedist Biruni (973. - oko 1050.) sastavio je opise dragog kamenja (Mineralogija) i izumio metodu za točno mjerenje njihove specifične težine. Drugi izvanredni znanstvenik Ibn Sina (Avicena) (oko 980.-1037.) u svojoj raspravi O kamenju dao je klasifikaciju svih poznati minerali dijeleći ih u četiri klase: kamenje i zemlja, fosilna goriva, soli, metali. U srednjem vijeku u Europi su se skupljale praktične informacije o mineralima. Rudar i tragač iz nužde su postali mineralozi praktičari i svoje iskustvo i znanje prenosili učenicima i pripravnicima. Prvi skup činjeničnih informacija o praktičnoj mineralogiji, rudarstvu i metalurgiji bilo je djelo G. Agricole O metalima (De re metallica), objavljeno 1556. godine. Zahvaljujući ovoj raspravi i ranijem djelu O prirodi fosila (De natura fossilium, 1546), koji sadrži klasifikaciju minerala na temelju njihovih fizičkih svojstava, Agricola je bio poznat kao otac mineralogije. 300 godina nakon objavljivanja Agricolinih radova, istraživanja u području mineralogije bila su posvećena proučavanju prirodnih kristala. Godine 1669. danski prirodoslovac N. Stenon, sažimajući svoja promatranja stotina kvarcnih kristala, uspostavio je zakon konstantnosti kutova između kristalnih lica. Stoljeće kasnije (1772.) Romé de Lisle potvrdio je Stenonove zaključke. Godine 1784. opat R. Gayuy postavio je temelje modernim idejama o strukturi kristala. Godine 1809. Wollaston je izumio reflektivni goniometar, koji je omogućio točnije mjerenje kutova između ploha kristala, a 1812. iznio je koncept prostorne rešetke kao zakona unutarnje strukture kristala. Godine 1815. P. Cordier predložio je proučavanje optička svojstva fragmenti usitnjenih minerala pod mikroskopom. Daljnji razvoj mikroskopskih istraživanja povezan je s izumom W. Nicola 1828. godine uređaja za proizvodnju polarizirane svjetlosti (Nicolova prizma). Polarizacijski mikroskop poboljšao je 1849. G. Sorby, koji ga je primijenio za proučavanje prozirnih tankih presjeka stijena. Pojavila se potreba za klasifikacijom minerala. Godine 1735. C. Linnaeus objavio je djelo Sustav prirode (Systema naturae), u kojem su minerali klasificirani prema vanjskim karakteristikama, t.j. baš kao biljke i životinje. Tada su švedski znanstvenici - A. Kronstedt 1757. i J. Berzelius 1815. i 1824. - predložili nekoliko opcija kemijske klasifikacije minerali. Druga Berzeliusova klasifikacija, koju je modificirao K. Rammelsberg 1841.-1847., čvrsto je utemeljena nakon što ju je američki mineralog J. Dana upotrijebio kao osnovu za treće izdanje Dana's System of Mineralogy, 1850. Veliki doprinos razvoju mineralogije u 18 - u prvoj polovici 19. stoljeća njemački znanstvenici A.G. Breithaupt i ruski - M.V. Lomonosov i V.M Kada su se kristali počeli proučavati rentgenskom analizom, došlo je do dubljeg razumijevanja strukture minerala. Godine 1912. njemački fizičar M. Laue eksperimentalno je ustanovio da se informacije o unutarnjoj strukturi kristala mogu dobiti propuštanjem rendgenskih zraka. kroz njih. Ova je metoda revolucionirala mineralogiju: pretežno deskriptivna znanost postala je preciznija i mineralozi su mogli povezati fizikalna i kemijska svojstva minerala s njihovim kristalnim strukturama. Krajem 19. - početkom 20. stoljeća. Razvoju mineralogije uvelike su doprinijeli radovi izvrsnih ruskih znanstvenika N.I.Vernadskog, A.E.Fersmana i drugih. mineralogija je usvojila nove istraživačke metode fizike čvrstog stanja, posebice infracrvenu spektroskopiju, cijeli niz rezonancijskih metoda (elektronska paramagnetska rezonancija, nuklearna gama rezonancija itd.), luminiscentnu spektroskopiju itd., kao i najnovije analitičke metode, uključujući analizu elektronskom mikrosondom, elektronsku mikroskopiju u kombinaciji s elektronskom difrakcijom itd. Korištenje ovih metoda omogućuje određivanje kemijskog sastava minerala "u točki", tj. na pojedinim zrncima minerala proučiti suptilne značajke njihove kristalne strukture, sadržaj i raspodjelu nečistoća, prirodu boje i luminiscencije. Uvođenje preciznih fizikalnih metoda istraživanja proizvelo je pravu revoluciju u mineralogiji. Imena takvih ruskih znanstvenika kao što su N. V. Belov, D. S. Korzhinsky, D. P. Grigoriev, I. I. Shafranovsky i drugi povezani su s ovom fazom razvoja mineralogije.
GLAVNA SVOJSTVA MINERALA
Dugo su glavne karakteristike minerala bile vanjski oblik njihove kristale i druge izlučevine, kao i fizikalna svojstva (boja, sjaj, cijepnost, tvrdoća, gustoća itd.), koja postoje i danas velika vrijednost u njihovom opisu i vizualnoj (osobito terenskoj) dijagnostici. Ove karakteristike, kao i optička, kemijska, električna, magnetska i druga svojstva, ovise o kemijskom sastavu i unutarnjoj strukturi (kristalnoj strukturi) minerala. Primarna uloga kemije u mineralogiji prepoznata je sredinom 19. stoljeća, no važnost strukture postala je očita tek uvođenjem radiografije. Prvo dekodiranje kristalnih struktura izveli su još 1913. engleski fizičari W. G. Bragg i W. L. Bragg. Minerali su kemijski spojevi (osim samorodnih elemenata). Međutim, čak i bezbojni, optički prozirni uzorci ovih minerala gotovo uvijek sadrže male količine nečistoća. Prirodne otopine ili taline iz kojih kristaliziraju minerali obično se sastoje od mnogo elemenata. Tijekom stvaranja spojeva, nekoliko atoma manje uobičajenih elemenata može zamijeniti atome glavnih elemenata. Takva je zamjena toliko uobičajena da se kemijski sastav mnogih minerala vrlo rijetko približava onom čistog spoja. Na primjer, sastav uobičajenog kamenotvornog minerala olivina varira unutar sastava dvaju tzv. krajnji članovi niza: od forsterita, magnezijevog silikata Mg2SiO4, do fajalita, željeznog silikata Fe2SiO4. Odnos Mg:Si:O u prvom mineralu i Fe:Si:O u drugom je 2:1:4. U olivinima srednjeg sastava omjeri su isti, t.j. (Mg + Fe):Si:O je 2:1:4, a formula je zapisana kao (Mg,Fe)2SiO4. Ako su poznate relativne količine magnezija i željeza, to se može odraziti na formulu (Mg0,80Fe0,20)2SiO4, iz koje se vidi da je 80% atoma metala predstavljeno magnezijem, a 20% željezo.
Struktura. Svi minerali, osim vode (koja se, za razliku od leda, obično ne klasificiraju kao minerali) i žive, na uobičajenim su temperaturama krutine. Međutim, ako se voda i živa jako ohlade, skrućuju se: voda na 0 °C, a živa na -39 °C. Na tim temperaturama, molekule vode i atomi žive tvore karakterističnu pravilnu trodimenzionalnu kristalnu strukturu (izrazi "kristalni " i "čvrsto") " u ovom su slučaju gotovo ekvivalentni). Dakle, minerali su kristalne tvari čija su svojstva određena geometrijskim rasporedom njihovih sastavnih atoma i vrstom kemijske veze među njima. Jedinična ćelija (najmanji dio kristala) sastoji se od pravilno raspoređenih atoma koji se zajedno drže elektronskim vezama. Ove sićušne stanice, koje se beskrajno ponavljaju u trodimenzionalnom prostoru, tvore kristal. Veličine jediničnih ćelija u različitim mineralima su različite i ovise o veličini, broju i relativnom rasporedu atoma unutar ćelije. Parametri ćelije izražavaju se u angstremima () ili nanometrima (1 = 10-8 cm = 0,1 nm). Elementarne ćelije kristala spojene čvrsto, bez razmaka, ispunjavaju volumen i tvore kristalnu rešetku. Kristali se dijele na temelju simetrije jedinične ćelije, koju karakterizira odnos između njezinih rubova i kutova. Obično postoji 7 sustava (redom rastuće simetrije): triklinski, monoklinski, rombski, tetragonalni, trigonalni, heksagonalni i kubni (izometrijski). Ponekad se trigonalni i heksagonalni sustavi ne odvajaju i opisuju zajedno pod nazivom heksagonalni sustav. Singonije su podijeljene u 32 kristalne klase (vrste simetrije), uključujući 230 prostornih skupina. Ove skupine prvi je identificirao 1890. godine ruski znanstvenik E.S.Fedorov. Rentgenskom difrakcijskom analizom određuju se dimenzije jedinične ćelije minerala, njegova singonija, klasa simetrije i prostorna skupina te se dešifrira kristalna struktura, tj. relativni raspored u trodimenzionalnom prostoru atoma koji čine jediničnu ćeliju.
GEOMETRIJSKA (MORFOLOŠKA) KRISTALOGRAFIJA
Kristali sa svojim ravnim, glatkim, sjajnim rubovima odavno privlače ljudsku pozornost. Od pojave mineralogije kao znanosti, kristalografija je postala osnova za proučavanje morfologije i strukture minerala. Utvrđeno je da površine kristala imaju simetričan raspored, što omogućuje da se kristal pripiše određenom sustavu, a ponekad i jednoj od klasa (simetrija) (vidi gore). Istraživanja rendgenskih zraka pokazala su da vanjska simetrija kristala odgovara unutarnjem pravilnom rasporedu atoma. Veličine mineralnih kristala variraju u vrlo širokom rasponu - od divova teških 5 tona (masa dobro oblikovanog kristala kvarca iz Brazila) do toliko malih da im se lica mogu razaznati samo pod elektronskim mikroskopom. Oblik kristala čak i istog minerala može se malo razlikovati u različitim uzorcima; na primjer, kristali kvarca su gotovo izometrični, igličasti ili spljošteni. Međutim, svi kristali kvarca, veliki i mali, šiljasti i plosnati, nastaju ponavljanjem identičnih jediničnih ćelija. Ako su te stanice usmjerene u određenom smjeru, kristal ima izdužen oblik; ako su u dva smjera nauštrb trećeg, tada je oblik kristala tabularan. Budući da kutovi između odgovarajućih ploha istog kristala imaju stalnu vrijednost i specifični su za svaku vrstu minerala, to je obilježje nužno uključeno u karakteristike minerala. Rijetki su minerali predstavljeni pojedinačnim dobro brušenim kristalima. Mnogo češće se javljaju u obliku nepravilnih zrna ili kristalnih nakupina. Često je mineral karakteriziran određenom vrstom agregata, što može poslužiti kao dijagnostička značajka. Postoji nekoliko vrsta jedinica. Dendritski razgranati agregati nalikuju lišću paprati ili mahovini i karakteristični su, na primjer, za piroluzit. Vlaknasti agregati koji se sastoje od gusto zbijenih paralelnih vlakana tipični su za krizotil i amfibol azbest. Kolomorfni agregati, koji imaju glatku zaobljenu površinu, građeni su od vlakana koja se pružaju radijalno iz zajedničkog središta. Velike okrugle mase su mastoidne (malahit), a manje su bubrežaste (hematit) ili grozdolike (psilomelan).
Ljuskasti agregati koji se sastoje od malih pločastih kristala karakteristični su za tinjac i barit. Stalaktiti su kapasto-kapne tvorevine koje vise u obliku ledenica, cjevčica, stožaca ili “zavjesa” u krškim špiljama. Nastaju kao rezultat isparavanja mineralizirane vode koja curi kroz vapnenačke pukotine, a često se sastoje od kalcita (kalcijev karbonat) ili aragonita. Ooliti, agregati koji se sastoje od malih kuglica i nalikuju ribljim jajima, nalaze se u nekim kalcitima (oolitni vapnenac), goethite (oolitna željezna ruda) i drugim sličnim formacijama.
KRISTALNA KEMIJA
Nakon prikupljanja rendgenskih podataka i njihove usporedbe s rezultatima kemijskih analiza, postalo je očito da značajke kristalne strukture minerala ovise o njegovom kemijskom sastavu. Tako su postavljeni temelji nova znanost - kristalokemija. Mnoga naizgled nepovezana svojstva minerala mogu se objasniti uzimajući u obzir njihovu kristalnu strukturu i kemijski sastav. Neki kemijski elementi (zlato, srebro, bakar) nalaze se u samorodnim, tj. čist, oblik. Građeni su od električki neutralnih atoma (za razliku od većine minerala, čiji atomi nose električni naboj i nazivaju se ionima). Atom s manjkom elektrona je pozitivno nabijen i naziva se kation; atom s viškom elektrona ima negativan naboj i naziva se anion. Privlačenje između suprotno nabijenih iona naziva se ionska veza i služi kao glavna vezna sila u mineralima. S drugom vrstom veze, vanjski elektroni rotiraju oko jezgri u zajedničkim orbitama, povezujući atome jedan s drugim. Kovalentna veza je najjača vrsta veze. Minerali s kovalentnim vezama obično imaju visoku tvrdoću i talište (na primjer, dijamant). Mnogo manju ulogu u mineralima ima slaba van der Waalsova veza koja se javlja između električki neutralnih strukturnih jedinica. Energija vezanja takvih strukturnih jedinica (slojeva ili skupina atoma) raspoređena je neravnomjerno. Van der Waalsove veze osiguravaju privlačnost između suprotno nabijenih regija u većim strukturnim jedinicama. Ova vrsta veze uočena je između slojeva grafita (jednog od prirodnih oblika ugljika), nastalih zbog jake kovalentne veze atoma ugljika. Zbog slabe veze između slojeva, grafit ima malu tvrdoću i vrlo savršenu cijepljivost, paralelnu sa slojevima. Stoga se grafit koristi kao mazivo. Suprotno nabijeni ioni približavaju se jedan drugome na udaljenost na kojoj odbojna sila uravnotežuje privlačnu silu. Za svaki određeni par kation-anion, ova kritična udaljenost jednaka je zbroju "radijusa" dva iona. Određivanjem kritičnih udaljenosti između različitih iona, bilo je moguće odrediti veličinu polumjera većine iona (u nanometrima, nm). Budući da većinu minerala karakteriziraju ionske veze, njihove se strukture mogu vizualizirati u obliku kuglica koje se dodiruju. Strukture ionskih kristala ovise uglavnom o veličini i predznaku naboja i relativnim veličinama iona. Budući da je kristal kao cjelina električki neutralan, zbroj pozitivnih naboja iona mora biti jednak zbroju negativnih. U natrijevom kloridu (NaCl, mineral halit) svaki natrijev ion ima naboj +1, a svaki kloridni ion -1 (slika 1), t.j. Svaki ion natrija odgovara jednom ionu klora. Međutim, u fluoritu (kalcijev fluorid, CaF2) svaki kalcijev ion ima naboj +2, a fluoridni ion ima naboj -1. Stoga, da bi se održala ukupna električna neutralnost iona fluora, ona mora biti dvostruko veća od iona kalcija (slika 2).
Karakterističan je i masni sjaj nefelina. Masivni nefelin ima masni sjaj i nazvan je eleolit. Ovo ime dolazi iz grčkog i znači Tsl. Nefelin je također posuđen iz grčki jezik a znači oblak kao aluzija na mutne ili prozirne kristale i mase.
Stoga se izraz "pijesak" odnosi na određeni raspon veličine zrna. Za razliku od većine drugih stijena, pješčenjak nije definiran specifičnom mineralnom populacijom. Glavnim mineralom obično se smatra kvarc. Pojedinačna zrnca pijeska, komponente, također mogu biti sastavljena od drugih minerala ili fragmenata stijena. Pješčenjak čije se komponente sastoje od više od 90% zrna kvarca naziva se kvarcni pješčenjak.
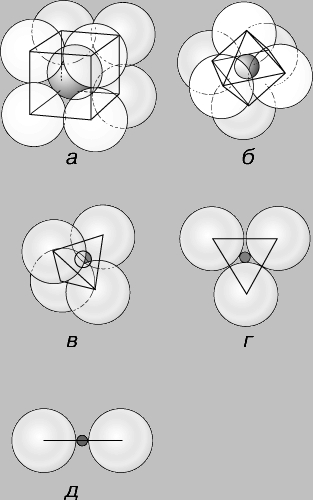
Mogućnost njihovog uključivanja u određenu kristalnu strukturu također ovisi o veličini iona. Ako su ioni iste veličine i pakirani na takav način da svaki ion dodiruje 12 drugih, tada su u odgovarajućoj koordinaciji. Postoje dva načina pakiranja kuglica iste veličine (slika 3): kubično tijesno pakiranje, koje općenito dovodi do stvaranja izometričnih kristala, i heksagonalno tijesno pakiranje, koje tvori heksagonalne kristale. Kationi su u pravilu manji od aniona, a njihove su veličine izražene u udjelima polumjera aniona, koji se uzima kao jedan. Obično se koristi omjer dobiven dijeljenjem polumjera kationa s polumjerom aniona. Ako je kation samo malo manji od aniona s kojima se spaja, može biti u kontaktu s osam aniona koji ga okružuju, ili, kako se obično kaže, u osmerostrukoj koordinaciji s obzirom na anione, koji se nalaze, kao bilo je, na vrhovima kocke oko njega. Ova koordinacija (koja se naziva i kubična) stabilna je pri omjerima ionskih radijusa od 1 do 0,732 (Sl. 4a). Pri manjem omjeru ionskog radijusa, osam aniona se ne može slagati u dodir s kationom. U takvim slučajevima, geometrija pakiranja dopušta šesterostruku koordinaciju kationa s anionima koji se nalaze na šest vrhova oktaedra (slika 4b), koji će biti stabilan pri omjerima njihovih polumjera od 0,732 do 0,416. Daljnjim smanjenjem relativne veličine kationa dolazi do prijelaza na četverostruku ili tetraedarsku koordinaciju, stabilnu pri omjerima radijusa od 0,414 do 0,225 (Slika 4c), zatim na trostruku koordinaciju unutar omjera radijusa od 0,225 do 0,155 (Slika 4c) i dvostruko - s omjerima polumjera manjim od 0,155 (slika 4,e). Iako drugi čimbenici također određuju vrstu koordinacijskog poliedra, za većinu minerala načelo omjera ionskog radijusa jedan je od učinkovitih načina predviđanja kristalne strukture.

Posebno označeni pješčenjaci
Odnosi se na stijenu glavnih agregata kalcita i kvarca. Odnosi se na pretežno tamno sivo-smeđe-sive poligene stijene s kotlovima kvarca, silikatnog škriljevca, glinenca, ali posebno mljevenog škriljevca. Oni su pokazatelj niske razine prometa u obrazovanju. Pješčenjaci su sedimentne ili sedimentne stijene nastale od rastresitog pijeska, sedimenta, stvrdnjavanjem. Vozila su voda, vjetar i led. Do taloženja pijeska dolazi zbog gravitacije kroz mehanički paragraf.
Minerali potpuno različitog kemijskog sastava mogu imati slične strukture koje se mogu opisati istim koordinacijskim poliedrima. Na primjer, u natrijevom kloridu NaCl, omjer polumjera natrijevog iona prema polumjeru klorovog iona je 0,535, što ukazuje na oktaedarsku ili šesterostruku koordinaciju. Ako se šest aniona grupira oko svakog kationa, onda da bi se održao omjer kationa i aniona 1:1, oko svakog aniona mora biti šest kationa. Ovo proizvodi kubičnu strukturu poznatu kao struktura tipa natrijevog klorida. Iako se ionski radijusi olova i sumpora oštro razlikuju od ionskih radijusa natrija i klora, njihov omjer također određuje šesterostruku koordinaciju, stoga PbS galenit ima strukturu tipa natrijevog klorida, tj. halit i galenit su izostrukturni. Nečistoće u mineralima obično su prisutne u obliku iona koji zamjenjuju ione minerala domaćina. Takve supstitucije uvelike utječu na veličinu iona. Ako su radijusi dvaju iona jednaki ili se razlikuju za manje od 15%, oni se lako supstituiraju. Ako je ta razlika 15-30%, takva je zamjena ograničena; kod razlike veće od 30% zamjena je praktički nemoguća. Postoje mnogi primjeri parova izostrukturnih minerala sličnog kemijskog sastava između kojih dolazi do ionske supstitucije. Tako su karbonati siderit (FeCO3) i rodokrozit (MnCO3) slične strukture, a željezo i mangan mogu se međusobno zamijeniti u bilo kojem omjeru, tvoreći tzv. čvrste otopine. Između ova dva minerala postoji kontinuirani niz čvrstih otopina. U ostalim parovima minerala ioni imaju ograničene mogućnosti međusobne supstitucije. Budući da su minerali električki neutralni, naboj iona također utječe na njihovu međusobnu supstituciju. Ako se supstitucija dogodi sa suprotno nabijenim ionom, tada se mora dogoditi druga supstitucija u nekom dijelu ove strukture, u kojoj naboj supstituirajućeg iona kompenzira povredu električne neutralnosti uzrokovanu prvom. Ova konjugirana supstitucija je zabilježena u feldspati- plagioklasi, kada kalcij (Ca2+) zamjenjuje natrij (Na+) uz stvaranje kontinuiranog niza čvrstih otopina. Višak pozitivnog naboja koji nastaje zamjenom iona Na+ ionom Ca2+ kompenzira se istovremenom zamjenom silicija (Si4+) aluminijem (Al3+) u susjednim područjima strukture.
FIZIČKA SVOJSTVA MINERALA
Iako su glavne karakteristike minerala (kemijski sastav i unutarnja kristalna struktura) utvrđene na temelju kemijskih analiza i rendgenske difrakcije, one se posredno odražavaju na svojstva koja se lako uočavaju ili mjere. Za dijagnosticiranje većine minerala dovoljno je odrediti njihov sjaj, boju, cijepnost, tvrdoću i gustoću. Sjaj je kvalitativna karakteristika svjetlosti koju reflektira mineral. Neki neprozirni minerali snažno odbijaju svjetlost i imaju metalni sjaj. To je uobičajeno u rudnim mineralima kao što su galenit (mineral olova), kalkopirit i bornit (minerali bakra), argentit i akantit (minerali srebra). Većina minerala apsorbira ili propušta značajan dio svjetlosti koja pada na njih i ima nemetalni sjaj. Neki minerali imaju sjaj koji prelazi iz metalnog u nemetalni, što se naziva polumetalnim. Minerali s nemetalnim sjajem obično su svijetle boje, neki od njih su prozirni. Kvarc, gips i svijetli liskun često su prozirni. Ostali minerali (na primjer, mliječno bijeli kvarc) koji propuštaju svjetlost, ali kroz koje se predmeti ne mogu jasno razlikovati, nazivaju se prozirni. Minerali koji sadrže metale razlikuju se od drugih po propuštanju svjetlosti. Ako svjetlost prolazi kroz mineral, barem u najtanjim rubovima zrna, onda je on, u pravilu, nemetal; ako svjetlost ne prolazi, onda je ruda. Međutim, postoje iznimke: na primjer, svijetli sfalerit (mineral cinka) ili cinober (mineral žive) često su prozirni ili prozirni. Minerali se razlikuju po kvalitativnim karakteristikama nemetalnog sjaja. Glina ima mutni, zemljani sjaj. Kvarc na rubovima kristala ili na prijelomnim površinama je staklast, talk, koji je podijeljen na tanke listiće duž ploha cijepanja, je sedef. Svijetli, pjenušavi, poput dijamanta, sjaj se naziva dijamant. Kada svjetlost padne na mineral nemetalnog sjaja, ona se djelomično odbija od površine minerala, a djelomično se lomi na ovoj granici. Svaku tvar karakterizira određeni indeks loma. Budući da se može mjeriti s velikom preciznošću, vrlo je korisna dijagnostička značajka minerala. Priroda sjaja ovisi o indeksu loma, a oba ovise o kemijskom sastavu i kristalnoj strukturi minerala. Općenito, prozirni minerali koji sadrže atome teških metala karakterizirani su visokim sjajem i visokim indeksom loma. Ova skupina uključuje uobičajene minerale kao što su anglezit (olovni sulfat), kasiterit (kositreni oksid) i titanit ili sfen (kalcijev titanijev silikat). Minerali koji se sastoje od relativno lakih elemenata također mogu imati jak sjaj i visok indeks loma ako su njihovi atomi čvrsto zbijeni i zajedno ih drže jake kemijske veze. Glavni primjer je dijamant, koji se sastoji od samo jednog laganog elementa, ugljika. U manjoj mjeri to vrijedi i za mineral korund (Al2O3), čije su prozirno obojene varijante - rubin i safiri dragog kamenja. Iako se korund sastoji od lakih atoma aluminija i kisika, oni su tako čvrsto povezani da mineral ima prilično jak sjaj i relativno visok indeks loma. Neki sjajevi (uljni, voštani, mat, svilenkasti itd.) ovise o stanju površine minerala ili o strukturi mineralnog agregata; smolasti sjaj karakterističan je za mnoge amorfne tvari (uključujući minerale koji sadrže radioaktivne elemente uran ili torij). Boja je jednostavan i prikladan dijagnostički znak. Primjeri uključuju mjedenožuti pirit (FeS2), olovno sivi galenit (PbS) i srebrnobijeli arsenopirit (FeAsS2). U drugim rudnim mineralima s metalnim ili polumetalnim sjajem, karakteristična boja može biti maskirana igrom svjetlosti u tankom površinskom filmu (potamnjenje). To je uobičajeno za većinu bakrenih minerala, posebno za bornit, koji se naziva "paunova ruda" zbog svoje preljevne plavo-zelene boje koja se brzo razvija nakon svježeg lomljenja. Međutim, drugi minerali bakra obojeni su u poznatim bojama: malahit - zelena, azurit - plava. Neki nemetalni minerali nepogrešivo se raspoznaju po boji koju određuje glavni kemijski element (žuta – sumpor i crna – tamnosiva – grafit itd.). Mnogi nemetalni minerali sastoje se od elemenata koji im ne daju određenu boju, ali imaju obojene varijante, čija je boja posljedica prisutnosti nečistoća kemijskih elemenata u malim količinama, koje se ne mogu usporediti s intenzitetom boje. uzrokuju. Takvi se elementi nazivaju kromofori; njihove ione karakterizira selektivna apsorpcija svjetlosti. Na primjer, tamnoljubičasti ametist svoju boju duguje neznatnoj primjesi željeza u kvarcu, a gustom zelena smaragd je povezan s malim sadržajem kroma u berilu. Boje u normalno bezbojnim mineralima mogu biti posljedica nedostataka u kristalnoj strukturi (uzrokovanih nepopunjenim položajima atoma u rešetki ili ugradnjom stranih iona), što može uzrokovati selektivnu apsorpciju određenih valnih duljina u spektru bijele svjetlosti. Zatim se minerali obojaju dodatnim bojama. Rubini, safiri i aleksandriti svoju boju duguju upravo tim svjetlosnim efektima. Bezbojni minerali mogu se obojiti mehaničkim uključcima. Tako tanka raspršena diseminacija hematita daje kvarcu crvenu boju, a kloritu zelenu. Mliječni kvarc zamućen je plinsko-tekućim inkluzijama. Iako je mineralna boja jedno od najlakše odredivih svojstava u mineralnoj dijagnostici, mora se koristiti s oprezom jer ovisi o mnogim čimbenicima. Unatoč varijabilnosti u boji mnogih minerala, boja mineralnog praha je vrlo konstantna, te je stoga važna dijagnostička značajka. Obično je boja mineralnog praha određena linijom (tzv. „boja linije”) koju mineral ostavlja kada prijeđe preko neglaziranog porculanskog tanjura (biskvita). Na primjer, mineral fluorit je obojen različite boje, ali linija mu je uvijek bijela.
dekoltea. Karakteristično svojstvo minerala je njihovo ponašanje pri cijepanju. Na primjer, kvarc i turmalin, čija površina prijeloma podsjeća na staklenu krhotinu, imaju konhoidalni prijelom. Kod drugih minerala, prijelom se može opisati kao grub, nazubljen ili rascjepkan. Za mnoge minerale karakteristika nije lom, već cijepanje. To znači da se cijepaju duž glatkih ravnina koje su izravno povezane s njihovom kristalnom strukturom. Vezne sile između ravnina kristalne rešetke mogu varirati ovisno o kristalografskom smjeru. Ako su u nekim smjerovima puno veći nego u drugim, tada će se mineral razdvojiti preko najslabije veze. Budući da je cijepanje uvijek paralelno s atomskim ravninama, može se označiti označavanjem kristalografskih smjerova. Na primjer, halit (NaCl) ima kockastu cijepanost, tj. tri međusobno okomita pravca mogućeg rascjepa. Cijepanje također karakterizira lakoća manifestacije i kvaliteta dobivene površine cijepanja. Tinjac ima vrlo savršenu cijepanje u jednom smjeru, t.j. lako se cijepa na vrlo tanke listove s glatkom sjajnom površinom. Topaz ima savršen dekolte u jednom smjeru. Minerali mogu imati dva, tri, četiri ili šest smjerova cijepanja, duž kojih se jednako lako lome, ili više smjerova cijepanja različitog stupnja. Neki minerali uopće nemaju cijepanje. Budući da je cijepanje, kao manifestacija unutarnje strukture minerala, njihovo stalno svojstvo, služi kao važna dijagnostička značajka. Tvrdoća je otpornost koju mineral pokazuje kada se grebe. Tvrdoća ovisi o kristalnoj strukturi: što su atomi u strukturi minerala čvršće povezani jedan s drugim, to ga je teže ogrebati. Talk i grafit su mekani minerali nalik ploči, izgrađeni od slojeva atoma međusobno povezanih vrlo slabim silama. Na dodir su masne: trljanjem po koži ruku skliznu pojedini tanki slojevi. Većina tvrdi mineral- dijamant u kojem su atomi ugljika tako čvrsto povezani da se može ogrebati samo drugim dijamantom. Početkom 19.st. Austrijski mineralog F. Moos poredao je 10 minerala prema rastućoj tvrdoći. Od tada se koriste kao standardi za relativnu tvrdoću minerala, tzv. Mohsova ljestvica (tablica 1). Tablica 1.
MOH SKALA TVRDOĆE
